根据中心原子杂化时所提供的空轨道所属电子层的不同,配合物可分为两种类型,即外轨配合物和内轨配合物。
若中心原子全部用最外层价电子的空轨道(ns、np、nd) 杂化成键,所形成的配键称外轨配键,对应的配合物称外轨配合物;另一种是中心原子用了次外层d 轨道,即(n - 1)d和最外层的ns,np 轨道进行杂化成键,所形成的配键称内轨配键,对应的配合物称为内轨配合物。
简介根据L.C.鲍林的价键理论,具有八面体结构并有4个未成对电子的、顺磁性的【CoF】,或有5个未成对电子的、顺磁性的【Fe(HO)】,其配位成键杂化轨道为4s4p4d,所用d 轨道与s和p轨道是属于同一主能级的。这类具有spd形式的配合物(见配位化合物), 因为使用了外层的d轨道,所以叫做外轨配合物。两种配合物的杂化成键轨道分别如图所示。 对于具有八面体结构且所有电子都是成对的、抗磁性的【Co(NH)】, 或具有1个未成对电子的、 顺磁性的【Fe(CN)】,其成键杂化轨道为3d4s4p,使用了比s和p轨道低一级主能级层中的d轨道。这类具有(-1)dsp型式的配合物,由于使用了内层的d轨道,所以叫做内轨配合物。
对于具有八面体结构且所有电子都是成对的、抗磁性的【Co(NH)】, 或具有1个未成对电子的、 顺磁性的【Fe(CN)】,其成键杂化轨道为3d4s4p,使用了比s和p轨道低一级主能级层中的d轨道。这类具有(-1)dsp型式的配合物,由于使用了内层的d轨道,所以叫做内轨配合物。
在四配位体系中,具有四面体结构且有两个未成对电子的顺磁性的【NiCl】,其成键杂化轨道为4s4p,属外轨配合物。而所有电子都成对的、抗磁性的【Ni(CN)】,其成键杂化轨道为3d4s4p,是平面正方形结构,属内轨配合物。1
定义根据中心原子杂化时所提供的空轨道所属电子层的不同,配合物可分为两种类型,即外轨配合物和内轨配合物。
若中心原子全部用最外层价电子的空轨道(ns、np、nd) 杂化成键,所形成的配键称外轨配键,对应的配合物称外轨配合物;另一种是中心原子用了次外层d 轨道,即(n - 1)d和最外层的ns,np 轨道进行杂化成键,所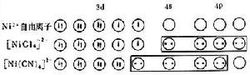 形成的配键称内轨配键,对应的配合物称为内轨配合物。如中心原子采取sp、sp3、sp3d2杂化轨道成键,形成配位数为2、4、6的配合物都是外轨配合物,中心原子采取dsp2或 d2sp3杂化轨道成键形成配位数为4 或 6 的配合物都是内轨配合物。1
形成的配键称内轨配键,对应的配合物称为内轨配合物。如中心原子采取sp、sp3、sp3d2杂化轨道成键,形成配位数为2、4、6的配合物都是外轨配合物,中心原子采取dsp2或 d2sp3杂化轨道成键形成配位数为4 或 6 的配合物都是内轨配合物。1
影响因素配合物是内轨型还是外轨型,主要取决于中心离子的电子构型、离子所带的电荷和配位原子的电负性大小。
具有(n - 1)d10构型的离子,只能用外层轨道形成外轨型配合物;具有(n - 1)d8构型的离子如在大多数情况下形成内轨塑配合物;具有(n-1 )d4-d7构型的离子,既可形成内轨型,也可形成外轨型配合物;具有(n - 1) d1-3构型的离子,一般形成内轨配合物。这类配合物往往含有空的(n - 1)d轨道,而含有空(n - 1)d轨道的内轨配合物大多不稳定。
中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多时,它对配位原子的孤电子对引力增强,利 于以其层 d 轨道参与成键。电负性大的原子如F、O等 ,与电负性较小的C 原子比较,通常不易提供孤电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型配合物。C原子作为配位原子时 则常形成内轨型配合物 。
内轨型配合物和外轨型配合物,其稳定性是不同的,一般内轨型配合物比外轨型配合物稳定。2
配合物简介为一类具有特征化学结构的化合物,由中心原子(或离子,统称中心原子)和围绕它的分子或离子(称为配位体/配体)完全或部分通过配位键结合而形成。
包含由中心原子或离子与几个配体分子或离子以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物。研究配合物的化学分支称为配位化学。
配合物是化合物中较大的一个子类别,广泛应用于日常生活、工业生产及生命科学中,近些年来的发展尤其迅速。它不仅与无机化合物、有机金属化合物相关连,并且与现今化学前沿的原子簇化学、配位催化及分子生物学都有很大的重叠。
显然含有配位键的化合物就不一定是配位化合物,如硫酸及铵盐等化合物中尽管有配位键,但由于没有过渡金属的原子或离子,故它们也就不是配位化合物。当然含有过渡金属离子的化合物也不一定是配位化合物,如氯化铁、硫酸锌等化合物就不是配位化合物。2
本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国